PGT-A NO INVASIVO
No invasivo PGT-A (niPGT-A) es un método de detección genética para blastocistos cultivados para su uso en el tratamiento de fertilización in vitro.- Identifica blastocistos con un anormal número de cromosomas
- Ayuda a los médicos a priorizar los mejores blastocistos para la implantación y así mejorar tasas de implantación y embarazos exitosos
- Es “no invasivo” ya que utiliza el medio de cultivo gastado en el que se cultivan los blastocisto
CAUSAS DEL FRACASO DE IMPLANTACIÓN
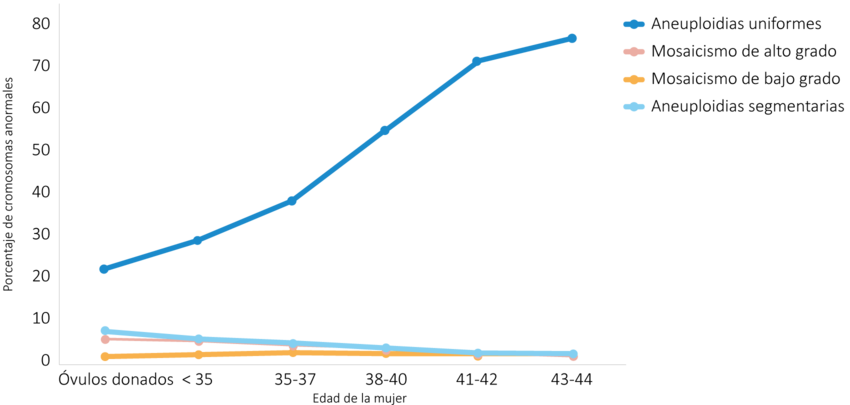
Una de las principales causas del fracaso de la implantación y del aborto espontáneo, es un número anormal de cromosomas (aneuploidía). La aneuploidía es común en los blastocistos húmanos y se vuelve cada vez más común con la edad. En promedio, una mujer a la edad de 40 años tendrá una tasa de incidencia de aneuploidía de más del 50 %, y a los 44 años la tasa de incidencia es casi del 80 % [1]Desafortunadamente, los blastocistos aneuploides son indistinguibles de los blastocistos euploides, tanto en la morfología como en la tasa de desarrollo, lo que los hace indetectables con el análisis morfológico convencional [2]. Como la transferencia de blastocistos aneuploides afecta negativamente el resultado reproductivo, es importante detectar la aneuploidía por otros medios durante el tratamiento de fertilización in vitro.
Figura 1. Frecuencia de anomalías cromosómicas detectadas en blastocistos según la edad de la mujer. Las aneuploidías uniformes describen la aneuploidía cromosómica completa distribuida en todas las células biopsiadas. El mosaicismo de alto grado, describe la aneuploidía cromosómica completa en el 50-70% de las células biopsiadas. El mosaicismo de bajo grado, describe la aneuploidía cromosómica completa en el 30-50% de las células biopsiadas. Las aneuploidías segmentarias, describen aneuploidías en segmentos >10 mb del cromosoma. (Modificado de: Navarro-Sánchez et al., 2022).
LA NUEVA TÉCNICA NO INVASIVA
El método más común empleado por las clínicas para la detección de aneuploidías es la prueba genética preimplantacional para aneuploidías (PGT-A). PGT-A puede aumentar el número de embarazos exitosos priorizando los blastocistos con los mejores perfiles cromosómicos. En el PGT-A convencional, se recolecta una biopsia del trofoectodermo y se extrae el ADN embrionario de los trofoblastos. Sin embargo, esta biopsia es potencialmente perjudicial para los blastocistos y sólo representa el recuento de cromosomas del trofectodermo y no el embrión en sí mismo [3].Recientemente, se desarrolló una alternativa no invasiva a la biopsia de trofoectodermo. Se descubrió que los blastocistos secretan ADN libre de células (cfDNA) en el medio de cultivo en el que han crecido. El uso de este cfDNA como muestra para un PGTA no invasivo (niPGT-A) ha demostrado ser muy eficaz. Este cfDNA ha demostrado ser tan representativo del embrión real como el ADN obtenido de la biopsia de trofoectodermo. También es muy probable que el origen del cfDNA se origine a partir de tejido de blastocisto sano, que representa tanto la masa celular interna como el trofectodermo [4].
niPGT-A ofrece una alternativa sin riesgos en comparación a el tradional PGT-A con biopsia, tiene una alta concordancia con trofectodermo, masa celular interna y el blastocisto completo. La base para el análisis es el medio de cultivo gastado (SCM) del crecimiento rutinario de blastocistos en clínicas de FIV. Como SCM se recoge y se desecha en vitrificación de los blastocistos, la incorporación de niPGT-A en el flujo de trabajo existente es casi perfecta
LIBRE DE BIOPSIA & INOFENSIVO = El nuevo niPGT-A
Sin daños – no invasivo
¿CÓMO ES NIPGT-A NO INVASIVO?
El blastocisto libera naturalmente ADN en su medio de cultivo. Tras la vitrificación del blastocisto, el medio de cultivo gastado se puede enviar a Amplexa Genetics para el análisis de niPGT-A. En Amplexa Genetics estamos especializados en extraer el ADN del medio de cultivo y realizar un test de aneuploidía sobre este ADN. Como no se requiere biopsia, el método no es invasivo para el blastocisto.¿QUE TAN EXACTO ES niPGT-A EN COMPARACIÓN CON PGT-A CON BIOPSIA?
Estudios recientes sobre la tasa de concordancia de niPGT-A en comparación con PGT-A con bipsia han logrado excelentes resultados. Parte de la mejora se debe a la eliminación de la contaminación materna en forma de células del cúmulo. Además, se ha encontrado que la mejor concentración de cDNA en el SCM se encuentra en el día 5 de crecimiento del blastocisto. Teniendo en cuenta estos factores, se ha encontrado que niPGT-A tiene tasas de concordancia más altas para la ploididad embrionaria que el PGT-A con biopsia (94% frente a 82%) [5].
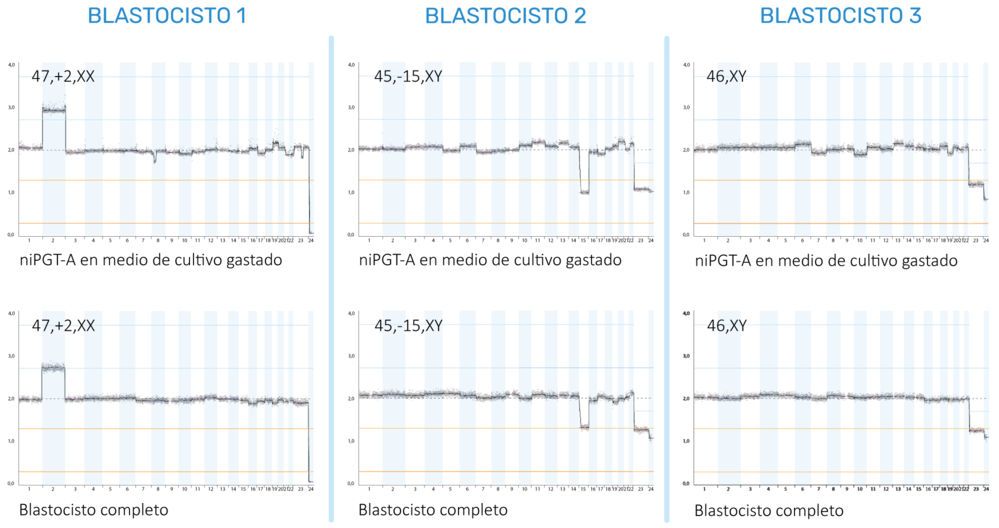
FIGURA 2 Perfiles cromosómicos basados en cfDNA del medio de cultivo gastado (SCM) y ADN extraído del blastocisto entero. Cada columna representa el mismo blastocisto, primero probado con niPGT-A en el SCM y luego con un PGT-A normal en todo el blastocisto en lugar de una biopsia de trofectodermo. El blastocisto completo representa el perfil cromosómico ideal ya que se basa en el perfil genético completo de la masa celular interna y el trofectodermo. Nuestros resultados muestran que el niPGT-A basado en el cfDNA del SCM tiene una alta concordancia con el blastocisto completo. El blastocisto 1 tiene una trisomía en el cromosoma 2, el blastocisto 2 carece de un cromosoma 15 y el blastocisto 3 tiene un perfil cromosómico saludable.
¿EL cfDNA ES REPRESENTANTE DEL EMBRIÓN?
Anteriormente se pensaba que el cfDNA provenía de células aneuploides apoptóticas dentro de los blastocistos, sin embargo, los blastocistos aneuploides no secretan más cfDNA que los blastocistos euploides [4]¿CÓMO SE LOGRAN LOS MEJORES RESULTADOS DE NIPGT-A?
Para lograr los mejores resultados de un niPGT-A, recomendamos los siguientes pasos durante el crecimiento del blastocisto:- Paso 1. Eliminación de las células del cúmulo materno: para evitar que el ADN materno contamine la muestra, es fundamental eliminar las células del cúmulo antes de colocar el ovocito en el medio de cultivo. Puede eliminarse químicamente o con un pin de denudación de 135 μm.
- Paso 2. Lavado de células: para garantizar que no quede ADN materno, recomendamos lavar los ovocitos minuciosamente para la siguiente denudación y transferirlos a nuevas bandejas de cultivo en gotas de 20 μl.
- Paso 3. Cantidad de muestra: Para obtener suficiente cfDNA en el medio, también recomendamos que los blastocistos se hayan cultivado en dicho medio durante un mínimo de 24 h. El SCM mínimo requerido para niPGT-A es de 6 μl, se recomienda recolectar tanto SCM como sea posible.
¿Cuándo es relevante realizar niPGT-A?
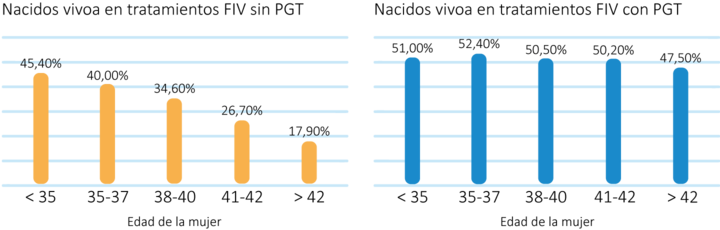
Dado que la aneuploidía aumenta significativamente con la edad, un análisis de niPGT-A se vuelve más relevante a medida que el paciente envejece. Según los datos del Informe resumido nacional de 2018, el análisis PGT es más efectivo en mujeres mayores de 38 años [6].REFERENCIAS
[1] L. Navarro-Sánchez, C.García-Pascual, C. Rubio, and C. Simón, “Non-invasive preimplantation genetictesting for aneuploidies: an update,” Reproductive BioMedicine Online,Jan. 2022, doi: 10.1016/j.rbmo.2022.01.012.
[2] A. Capalbo et al.,“Correlation between standard blastocyst morphology, euploidy and implantation: An observational study in two centers involving 956 screened blastocysts,” HumanReproduction, vol. 29, no. 6, pp. 1173–1181, 2014, doi:10.1093/humrep/deu033.
[3] H. F. Chen, M. Chen, and H. N. Ho, “An overview of the current and emerging platforms for preimplantation genetic testing for aneuploidies (PGT-A) in in Vitro fertilization programs,” Taiwanese Journal of Obstetrics and Gynecology, vol. 59, no. 4. Elsevier Ltd, pp. 489–495, Jul. 01, 2020. doi:10.1016/j.tjog.2020.05.004.
[4] M. Vera-Rodriguez et al., “Origin and composition of cell-free DNA in spent medium from human embryo culture during preimplantation development,” Human Reproduction, vol. 33, no. 4, pp. 745–756, Apr. 2018, doi: 10.1093/humrep/dey028.
[5] L. Huang, B. Bogale, Y.Tang, S. Lu, X. S. Xie, and C. Racowsky, “Noninvasive preimplantation genetic testing for aneuploidy in spent medium may be more reliable than trophectoderm biopsy,” Proceedings of the National Academy of Sciences of the United States of America, vol. 116, no. 28, pp. 14105–14112, 2019, doi:10.1073/pnas.1907472116.
[6] “2018data reported by National Summary Report,” https://www.sartcorsonline.com/rptCSR_PublicMultYear.aspx